Clinical Trials Conduct Units et support transversal
À l’H.U.B, nous sommes fiers de l’organisation rigoureuse et innovante mise en place pour garantir l’excellence dans la conduite des essais cliniques. Les Clinical Trials Conduct Units (CTCU) incarnent cette ambition, assurant une gestion optimale des études tout en plaçant les patients et les thérapies innovantes au cœur de nos préoccupations. Ces 3 CTCU, soutenus par des experts transversaux de haut niveau, témoignent de la force collective de l’H.U.B dans la conduite d’essais cliniques. Cette organisation structurée et innovante positionne l’H.U.B comme un acteur majeur dans le domaine de la recherche clinique, au service de l’innovation médicale et du bien-être des patients.
Depuis sa création, l’H.U.B a placé la recherche et l’innovation au centre de sa stratégie de développement, avec une Direction de la Recherche et un Centre de l’Innovation Médicale (CIMH) au cœur de sa structure. Les résultats parlent d’eux-mêmes : un chiffre d’affaires annuel de 21 millions d’euros, une production scientifique de haut niveau avec 900 publications, 40 thèses de doctorat soutenues et plus de 300 nouvelles études initiées chaque année.
Les CTCU : une organisation structurée et cohérente
Les CTCU, répartis au sein de nos trois hôpitaux, sont des structures dédiées à la mise en œuvre et au suivi des essais cliniques :
- CTCU Oncologie situé à l’Institut Jules Bordet.
- CTCU Transversal à l’Hôpital Erasme, couvrant les spécialisations médicales hors oncologie et pédiatrie.
- CTCU Pédiatrique localisé à l’HUDERF.
Ces unités, englobant toutes les phases d’essais, des plus précoces (comme la Novel Treatment Unit à l’Institut Bordet) aux phases post-commercialisation, assurent une prise en charge harmonieuse et efficace :
- Gestion centralisée : Uniformisation des pratiques et formations communes pour le personnel.
- Cohérence des études : Harmonisation du suivi des essais cliniques dans les trois hôpitaux.
- Flexibilité des ressources : Optimisation des moyens humains et matériels.
- Communication fluide : Renforcement de la collaboration entre les équipes opérationnelles, les chefs de clinique et les départements.
Les CTCU assurent la gestion complète des essais cliniques :
- Planification et activation des sites cliniques.
- Inclusion et suivi des patients, garantissant leur sécurité et le respect des protocoles.
- Conformité avec les normes éthiques, réglementaires (locales, européennes et internationales) et les Bonnes Pratiques Cliniques (BPC).
- Gestion des données et coordination des visites de contrôle jusqu’à la clôture des essais.
Ces unités sont un pilier fondamental pour garantir la rigueur, la sécurité et l’efficience des essais cliniques au sein de l’H.U.B.
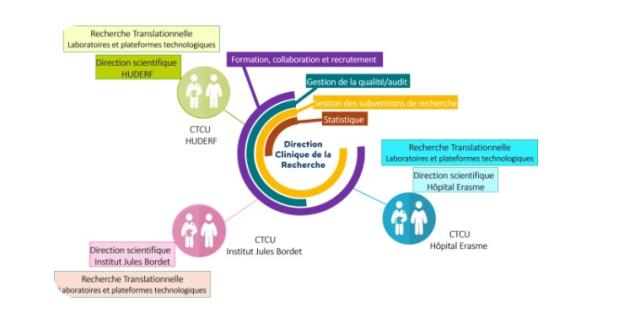
Les supports transversaux : une expertise complémentaire au service de l’excellence
Gestion de la qualité
Le rôle de la qualité est central pour assurer la conformité et la qualité des essais cliniques :
- Veille réglementaire : S’assurer du respect des normes locales et internationales (BPC, consentement éclairé, etc.).
- Processus qualité : Développement et surveillance des procédures garantissant une rigueur optimale dans la conduite des essais.
- Formation du personnel : Sessions régulières pour informer et former les équipes sur les exigences réglementaires et les bonnes pratiques.
- Gestion des audits : Préparation, suivi et gestion des risques, tout en assurant une documentation complète et conforme des études.
Gestion de la collaboration
La collaboration entre les différentes équipes joue un rôle essentiel dans l’établissement et le maintien des partenariats stratégiques :
- Facilitation des collaborations : Avec les institutions académiques, les entreprises pharmaceutiques et les CRO pour dynamiser la recherche clinique.
- Recrutement et formation : Identification et intégration des talents nécessaires (coordinateurs d’études, data managers, etc.) pour assurer le succès des projets.
- Développement de synergies : Promotion d’une communication fluide entre les parties prenantes pour optimiser les études cliniques.
Clinical Biostatistic Unit : pilier stratégique de la qualité des études cliniques à l’H.U.B.
Le développement du CBU constitue un pilier stratégique pour garantir la qualité scientifique et méthodologique des études cliniques menées à l’H.U.B. En collaboration étroite avec les équipes médicales et de recherche, la CBU accompagne toutes les étapes d’un projet :
- Conception des études : Développement des protocoles, sélection des méthodes statistiques et calcul de la taille d’échantillon.
- Analyse des données : Validation des bases de données, analyses statistiques complexes et interprétation rigoureuse des résultats.
- Fiabilité des résultats : Gestion des données aberrantes et manquantes pour assurer des conclusions exploitables et conformes.
- Contribution scientifique : Participation active à la rédaction d’articles, soumissions aux comités d’éthique et présentations lors de conférences internationales.
- Formation continue : Sessions dédiées pour renforcer les compétences en biostatistique et en analyse de données des chercheurs et cliniciens.
Grâce à son expertise, la CBU joue un rôle clé dans l’avancement méthodologique de la recherche clinique, assurant la rigueur et la crédibilité des projets scientifiques de l’H.U.B.
Un environnement collaboratif et performant
La synergie entre les CTCU et les unités de support transversales crée un écosystème dynamique où chaque acteur contribue à l’excellence de nos études cliniques. Cette organisation harmonisée nous permet de :
- Faciliter l’accès aux thérapies innovantes pour nos patients.
- Optimiser les ressources grâce à une gestion centralisée et flexible.
- Assurer la qualité et la conformité de nos essais grâce à un suivi rigoureux et transparent.
- Renforcer nos collaborations avec des partenaires académiques et industriels de premier plan.